Katalaz enzimi: temel özellikler
Katalaz - hemen hemen tümünde bulunan bir enzimcanlı organizmalar. Ana işlevi hidrojen peroksitin vücuda zararlı olmayan maddelere dekompozisyon reaksiyonunu katalize etmektir. Katalaz, hücrelerin yaşamsal etkinliği için onları önemli oksijen aktif formları tarafından imha korur gibi önemlidir.

Genel bilgi
Enzim katalaz, indirgeyici molekül (verici) ile oksitleyici moleküle (alıcıya) elektron transferini katalize eden geniş bir enzim sınıfı olan oksidoredüktazları ifade eder.
İnsanda katalaz için optimum pHvücut yaklaşık 7, ancak reaksiyon hızı, hidrojen indeksi değerlerinde 6.8'den 7.5'e anlamlı bir şekilde değişmez. Diğer katalazlar için optimum pH, organizmanın türüne bağlı olarak 4 ila 11 arasında değişir. Optimum sıcaklık da değişir, bir kişi için yaklaşık 37'diryaklaşık S.
Katalaz en hızlı enzimden biridir. Sadece bir molekül, milyonlarca hidrojen peroksit molekülünü saniyede suya ve oksijene dönüştürebilir. Enzimoloji açısından, bu, katalaz enziminin çok sayıda devrimle karakterize edildiği anlamına gelir.
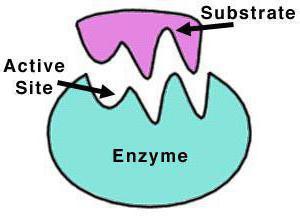
Enzimin yapısı
Katalaz dörtlü bir tetramerpolipeptit zincirleri, bunların her biri 500'den fazla amino asit uzunluğuna sahiptir. Enzim, oksijenin aktif formlarıyla reaksiyona giren ve dört porfiri heme grubuna sahiptir. Oksitlenmiş heme, katalazın protez grubudur.
Keşif öyküsü
Katalaz 1818 yılına kadar bilim insanları tarafından bilinmiyordu,Yaşayan hücrelerde hidrojen peroksit keşfeden bir kimyager olan Louis Jacques Tenar, tahribatının önceden bilinmeyen bir biyolojik maddenin eyleminden kaynaklandığını düşünmüyordu.

1900 yılında Alman kimyacı Oscar Levasıperoksiti bozan gizemli bir maddenin tanımlanması için "katalaz" terimi. Ayrıca katalaz enziminin bulunduğu soruyu cevaplamayı başardı. Çok sayıda deney sonucunda, Oscar Lev, bu enzimin neredeyse tüm hayvanların ve bitki organizmalarının karakteristik olduğunu ortaya çıkardı. Canlı bir hücrede, diğer birçok enzim gibi, peroksisomlarda katalaz bulunur.
1937'de ilk kez kristalleşmek mümkün oldusığır karaciğerinden katalaz. 1938'de, enzimin moleküler kütlesi 250 kDa olarak belirlendi. 1981'de, bilim adamları üç boyutlu katalazın bir yapısının görüntüsünü aldı.
Hidrojen peroksidin katalizlenmesi
Hidrojen peroksitin birçok normal metabolik sürecin bir ürünü olmasına rağmen, vücuda zararsız değildir.
Canlı dokularda hidrojen peroksit ayrışmasının reaksiyonu:
2 H2Ey2 → 2 H2O + O2
Peroksit bölünmesinin moleküler mekanizmasıHidrojen katalaz enzimi henüz çalışılmamıştır. Tepkimenin iki aşamada gerçekleştiği varsayılmaktadır - ilk aşamada, katalazın protez grubunda bulunan peroksitin oksijen atomuna bağlanırken, bir su molekülü salınmaktadır. İkinci aşamada, oksitlenmiş heme başka bir hidrojen peroksit molekülü ile reaksiyona girerek, başka bir su molekülünün ve bir oksijen molekülünün oluşumuna neden olur.
Katalaz enziminin bu etkisinden dolayıHidrojen peroksit, bu aktif maddenin doku örneklerinde varlığını belirlemek kolaydır. Bunu yapmak için, numuneye az miktarda hidrojen peroksit ekleyin ve reaksiyonu gözlemleyin. Bir enzimin varlığı, oksijen kabarcıklarının oluşmasıyla belirtilmektedir. Bu reaksiyon iyidir çünkü herhangi bir özel ekipman veya alet gerektirmez - çıplak gözle gözlemlenebilir.

Herhangi bir ağır metal iyonunun dikkati çekiyor.Rekabetçi olmayan katalaz inhibitörü olarak hareket edebilir. Ek olarak, bilinen tüm siyanür, dokularda bir çok hidrojen peroksit varsa, rekabetçi bir katalaz inhibitörü olarak davranır. Arsenatlar aktivatörlerin rolünü oynar.
uygulama
Katalaz enziminin hidrojen peroksit üzerindeki bozunur etkisi gıda endüstrisinde uygulama bulmuştur - bu enzim sütü çıkarır 'H2aman2 peyniri pişirmeden önce. Başka bir uygulama, ürünleri oksidasyondan koruyan özel gıda ambalajıdır. Katalaz, ayrıca tekstil endüstrisinde, hidrojen peroksiti dokulardan uzaklaştırmak için de kullanılır.
Küçük miktarlarda kullanılırkontakt lenslerin hijyeni. Bazı dezenfektanlar bileşimde hidrojen peroksite sahiptir ve lensleri tekrar kullanmadan önce bu bileşeni parçalamak için katalaz kullanılır.
etkinlik
Katalaz enziminin aktivitesi yaşa bağlıgövde. Genç dokularda, enzimin aktivitesi eskilerden daha yüksektir. Hem insanlarda hem de hayvanlarda yaşla birlikte, katalaz aktivitesi, organ ve dokuların yaşlanması sonucu yavaş yavaş azalır.
Yakın tarihli bir araştırmaya göre, bir azalmaKatalazın aktivitesi saçın grileşmesinin olası nedenlerinden biridir. Hidrojen peroksit insan vücudunda sürekli olarak oluşur, ancak zarar vermez - katalaz hızla parçalara ayrılır. Ancak bu enzimin seviyesi azalırsa, tüm hidrojen peroksidin enzim tarafından katalize edilmediği açıktır. Böylece, doğal boyaları çözerek, saçları içten ayırır. Bu beklenmedik keşif şimdi araştırmacılar tarafından test ediliyor ve belki de, saçların gölgelenmesini askıya alan ilaçların geliştirilmesinde rol oynayacaktır.
</ p>