Bileşiklerin oksijen değeri nedir?
Olası değerleri belirlemek içinoksijen değerliliği, periyodik tablodaki elementin pozisyonunu, atom yapısının ana özelliklerini incelemeliyiz. Böyle bir yaklaşım oksijen değerinin tipik olduğu ve bunun için karakteristik olmayan sorunun incelenmesinde uygundur. En yaygın bileşiklerde, olağan değerlik II'dir. Bu özellik oksijen içeren bitmiş ikili formüllerde bir başka atomun bağ sayısını belirlemeyi mümkün kılar.
Oksijen değeri nedir?
Hakkında bilgi birikiminin ilk aşamasındaözellikleri ve maddelerin yapısı, kimyagerler değerli maddenin belirli bir sayıda atomu bir maddenin molekülüne bağlama yeteneği olduğunu düşünüyordu. Birçok bilim adamı, element keşfinden sonra, oksijenin valansının ne olduğunu anlamaya çalıştı. Cevap deneysel olarak elde edildi: oksijen kimyasal reaksiyona iki atomlu tek değerlikli hidrojen ekliyor, bu da iki değerli olduğu anlamına geliyor. Kimyasal bağlantının temsilleri, biriken maddenin yapısı hakkında bilgi değişti. Değerlik teorisinde, G. Lewis ve V. Kossel, elektronik yapı açısından kimyasal etkileşimin özünü ifşa eder. Araştırmacılar, bir atomun en kararlı enerji durumuna çalışarak belli sayıda bağ oluşturabilme kabiliyetini açıkladı. Elde edilirse, maddenin en küçük parçacığı daha kararlı hale gelir. Lewis teorisi ve yapılarında, kimyasal bir bağ oluşturulmasına katılan dış elektronların rolüne çok dikkat edilir.

Periyodik tabloda oksijen yerleştirme özellikleri
Hangi valans değerini belirlemek içinoksijen, elektronik yapısının bazı özelliklerini dikkate almak gerekir. Oksijen periyodik masanın 16. grubunu oluşturur. Ailenin önemsiz adı "kalkojen" dir, eski sınıflamaya göre VI (A) grubuna yönlendirilirler. Periyodik tabloda oksijen 8 numaralı hücrede hücredir. Çekirdek, 8 pozitif ve çok sayıda nötr temel parçacık içerir. Bir atomun uzayında, 8 elektron hareket ederken ortaya çıkan, bunlardan 6'sı harici olmak üzere iki enerji düzeyi vardır.

Atomun bileşimi ile değerlik arasındaki ilişki nedir?
Oksijen atomunun son seviyesi 2eşleşmemiş elektronlar. Element, elektronegatiflik değeriyle (kendisine bağlanan elektron çifti çekebilme yeteneği) flordan daha düşüktür. Diğer elementler ile bileşiklerin oluşumunda, oksijen kendisine, molekülde (fluor elektronları hariç) ortaya çıkan toplam elektronik yoğunluğu çeker. Dış kabuğun kararlı duruma getirilmesi, iki negatif yük eklenmesiyle mümkündür. Bu, oksijenin 2 elektron gerektirdiği anlamına gelir. Olası seçenekler şunlardır: bir elektron (valans II) almak, başka bir atomdan (valans II) 2 elektron seçin, diğer atomlardan elektron almayın (valans 0). Oksijenin tipik davranışı ikinci vaka ile karakterizedir. Bu şekilde, hangi oksijenin ortak bileşiklerinde en tipik olduğunu bulmak için kullanabilirsiniz. Bunlar, metallerin ve ametallerin oksitlerinin çoğunu içerir.

Bileşiklerde valans nasıl belirir?
Oksijen doğrudan doğruyaBirçok kimyasal elementle etkileşim kurabilir. Bilinen periyodik tablonun hemen hemen tüm temsilcileri ile (inert gazlar hariç: argon, helyum, neon) bilinmektedir. Halojenlerle, asal metallerle reaksiyonda oksijen doğrudan giremez, ancak Au oksitler2Ey3, F2O, Cl2Ey7 ve diğerleri var (dolaylı olarak alıyorlar). Oksijene katılan oluşumdaki ikili bileşikler için kovalent bağlanma ve polarite karakteristiktir. Bu tür moleküllerde değerlik, farklı atomların çekirdeğinin çektiği ortaya çıkan elektron çiftlerinin sayısına bağlıdır. Bileşiklerin büyük çoğunluğunda, oksijen atomları iki kovalent bağ oluşturmaya katılırlar. Örneğin, CO oksitlerinde2, P2aman5, Tamam2, Tamam3, K2O, B2aman3, Mo2aman5 ve diğer moleküllerde. Hidroniyum katyonunda H3O + oksijen, atipik bir valans III gösterir. Perokso grubunun -O-O- varlığının nedeni, hidrojen peroksitin H2aman2. Bu bileşikte, oksijen kendi doğal değerini sergiler II.
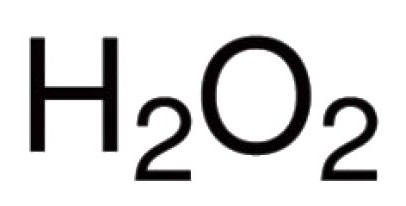
Elemanların valanslarını nasıl belirleyebilirim?
Oksijenin valans olasılıkları fikriLewis yapısını - elektronların dış tabakayı işaretlediği elemanın kimyasal işaretini verir. Moleküler oluşumunda yer alırlar, ortak elektronik çiftlerin bir parçasıdırlar. Lewis formülü, eşleşmemiş elektronlarının sayısına karşılık gelen oksijen değerini açıkça gösterir (2). Aynı sonuç, grafik elektronik yapıların kullanımı ile sağlanır. Oksijenin harici enerji seviyesinin iki hücresinde, eşleşmemiş elektronlar bulunur (formüldeki oklarla gösterilir). Oksijenin değerliliği hakkında bilgi bitmiş ikili bileşik formülünden komşu atomların değerini belirlemeyi mümkün kılar. Bu amaçla basit hesaplamalar yapılır. İlk olarak, O atomlarının sayısı olağan valans oksijeninin üssü ile çarpılır. Elde edilen değer, oksijenle bağlantılı başka bir elementin kimyasal sembolünün yanında bulunan formülde gösterilen indeksle bölünmelidir. Basit bir yöntem kullanarak karbon ve fosforun oksitleri içindeki valanslarını hesaplarız.
- CO dioksitin 0 işaretinin altındaki sağ alt simge çarpılır2 elementin tipik değerine: 2 • 2 = 4. Nihai sayı, karbon için belirtilen endekse bölünür: 4/1 = 4. CO 2'de CO2 karbon en yüksek değerlik durumundadır IV.
- Fosfor oksitte oksijenin kimyasal simgesinin sağ altındaki indis2aman5 O atomunun tipik valansı ile çarpın: 5 • 2 = 10. Bu sayıyı, aşağıdaki formülde, fosfor atomundan: 10/2 = 5'deki sağdaki indekte bölüyoruz. Okside, fosfor yüksek değerlik halindedir. V.