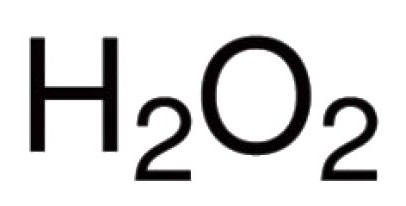Oksijen ... Oksijen formülüdür. Oksijen molekülü
Dünya üzerindeki tüm maddeler arasında, özel bir yer şu unsurlar tarafından işgal edilir:hayatın sağladığı şey oksijendir. Gezegenimizi diğerlerinden daha özel yapan, onun varlığıdır. Bu madde sayesinde, dünyada çok sayıda güzel canlı var: bitkiler, hayvanlar, insanlar. Oksijen kesinlikle vazgeçilmez, benzersiz ve son derece önemli bir bileşiktir. Bu nedenle, bunun ne olduğunu, özelliklerini öğrenmeye çalışın.

Kimyasal element oksijen: karakteristik
Öncelikle, periyodik tablodaki bu elementin konumunu karakterize ettik. Bu birkaç öğe ile yapılabilir.
- Seri numarası 8'dir.
- Atom kütlesi 15.99903'tür.
- Sistemin ikinci periyodunun ana alt grubunun altıncı grubunda bulunur.
- Çekirdeğin yükü +8, protonların sayısı 8, elektronların sayısı 8, nötronların sayısı 8'dir. Böylece çift sihirli sayı elde edilir, bu nedenle ana izotopik formun kararlılığı gözlemlenir 16O.
- Elemanın Latince adı oksijendir. Rus - oksijen, bu isim "asitleri doğurmak" ifadesinden oluşur. Aynı zamanda bir eşanlam vardır, bazen buna oksijen denir.
Atomun elektronik yapısının analizine özel dikkat gösterilmelidir çünkü molekülün kararlılığı ve sergilenen fiziksel ve kimyasal özellikler açıklanmaktadır.
Molekül yapısı
Atomun elektronik konfigürasyonu 1s formülüyle temsil edilir22s22p4. Bu kayıttan anlaşıldığı üzere, enerji seviyesinin tamamlanmasından ve sözleşmeli sekizliğin oluşturulmasından önce oksijen iki elektron içermez. Bu onun aşağıdaki özelliklerini açıklıyor:
- oksijen molekülü diatomiktir;
- elementin oksidasyon derecesi her zaman -2'dir (peroksitler ve flor oksit hariç, sırasıyla -1 ve +2 ile değişir);
- en güçlü oksidandır;
- Normal şartlar altında bile kolaylıkla reaksiyona girer;
- patlayıcı bileşikler oluşturabilir.
Şimdi yapı sorunu düşünün. Bir oksijen molekülü nasıl oluşur? Birincisi, oluşum mekanizması, her bir atomun elektronlarının sosyalleşmesinden dolayı kovalent kutupsuzdur. Böylece, bağ da kovalent kutupsuzdur. Bu durumda, atomların her biri dış seviyede iki eşleşmemiş elektrona sahip olduğundan çifttir. Oksijenin neye benzediğini çok basitçe resimleyebilirsiniz. Formül aşağıdaki gibidir: О2 veya O = O
Böyle bir bağın varlığı nedeniyle, molekül çok kararlıdır. Onunla ilgili birçok reaksiyon için özel koşullar gereklidir: artan basınç, ısıtma, katalizör kullanımı.
Kimyasal bir element olarak oksijen bir atomdur.Doğada kararlı bir şekilde mevcut üç izotop vardır. Onların kütle numaraları sırasıyla 16, 17, 18'dir. Ancak, yüzde oranı çok farklıdır, 16% 99.759 ve geri kalan% 0.5'den az. Bu nedenle, en yaygın ve kararlı izotop tam olarak 16 kütle büyüklüğündedir.

Basit madde oksijen
Bu öğeyi basit olarak konuşursakBağlantı, daha sonra normal koşullar altında derhal durumu gösterir. Oksijen, tadı, rengi ve kokusu olmayan bir gazdır. Hidrojen ve soylu bir helyum gazı sonrasında, gezegendeki en bol madde olan diyatomik bir moleküldür.
Bu maddenin diğer agrega halleri vardır. Yani, -183'lük bir negatif sıcaklıkta0C oksijen, güzel bir mavi sıvıya yoğunlaşır. -200 eşiğini aşarsanız0C, sıvı monoklinik iğne benzeri bir şeklin parlak mavi kristallerine dönüşecektir.
Katı halde üç ana oksijen varlığı vardır.
- Alfa formu (a-O2). 200'ün altında bir sıcaklık var 0S.
- Beta formu (β-O2). Sıcaklık aralığı -200-4000S.
- Gamma formu (γ-O2). -400 ila -500 arası aralık0S.
Oksijen en önemli ve önemli olanlardan biridir.gazlar. Sadece gezegendeki canlı varlıkların hayatı için değil, bir bütün olarak doğa için. Bir element olarak dahil edilmeyeceği doğal bir mineral veya bileşiğin ismini vermek zordur.
Keşif öyküsü
İlk sözü havadaVIII. yüzyılda ortaya çıkan yanma süreçlerini destekleyen bir çeşit gaz var. Ancak, o zaman, onu incelemek, varlığını kanıtlamak ve açmak için teknik bir olanak yoktu. Sadece bir bin yıl sonra, 18. yüzyılda, bu birkaç bilim adamının çalışmaları sayesinde yapıldı.
- 1771 Karl Scheele deneysel olarak hava bileşimini oluşturdu ve ana iki gazın oksijen ve azot olduğunu keşfetti.
- Pierre Bayen, civa ve oksitinin ayrışması üzerine deneyler yapar ve sonuçları resmi olarak kaydeder.
- 1773 Sheele resmen oksijen bileşenini açar, ancak onu saf formda almaz.
- 1774 Priestley, Scheele'den bağımsız olarak yaptığı gibi aynı şeyi yapar ve cıva oksijeni ayrıştırarak saf oksijeni alır.
- 1775 Antoine Lavoisier bu elemente isim verir ve yüz yıldan uzun süredir var olan bir yanma teorisi yaratır.
- 1898 Thompson, toplumun atmosfere büyük karbondioksit emisyonları nedeniyle havanın oksijeninin bitebileceğini düşünmesini sağlar.
- Aynı yıl Timiryazev tam tersini kanıtlıyor, çünkü oksijen tedarikçisinin gezegenin yeşil bitkileri olduğunu açıklıyor.
Böylece,Yaşam için önemli ve anlamlı olan oksijeni temsil eder. Maddenin tüm fiziksel ve kimyasal özellikleri incelendikten sonra, hazırlanma yöntemleri ele alınmış, sudaki yaklaşık içerik, yer kabuğu, atmosfer ve gezegenin diğer yerleri hesaplanmıştır.

Fiziksel özellikler
Bu bileşiğin karakterize edilebileceği ana fiziksel parametreleri veriyoruz.
- Oksijen, normal koşullar altında, havanın ayrılmaz bir parçası olan bir gazdır (% 21). Rengi, tadı ve kokusu yoktur. Havadan daha hafif, suda yetersiz çözünür.
- Kömür ve metal tozları tarafından aktif olarak emilir, organik maddeler içinde çözünür.
- Kaynama noktası-1830S.
- Eriyen -218.350S.
- Yoğunluğu 0.0014 g / cm3.
- Kristal kafes molekülerdir.
Oksijen sıvı halde paramanyetik özelliklere sahiptir.
Kimyasal özellikler
Söz konusu gaz ne kadar aktif, nasılKimya, diğer maddelerle reaksiyon halinde davranır, ayrıntılı olarak anlatır. Oksijen, bir dereceye kadar oksidasyon sergileyebilir, bununla birlikte en sık, -2, sabit olarak kabul edilir. Ek olarak, değerlerin aşağıdaki gibi olduğu bileşikler vardır:
- 1;
- -0.5;
- -1/3;
- 0.5;
- + 1;
- 2.
Kimyasal aktivite yüksek tarafından açıklanmıştırelektronun afinitesi, Polling'e göre elektronegatifliğin değeri 3.44'tür. Sadece florürde daha yüksek (4). Bu nedenle oksijen çok güçlü bir oksidandır. Aynı zamanda, daha güçlü oksidanlarla reaksiyonlarda, bir indirgeyici ajan olarak davranır ve pozitif bir oksidasyon durumu sergiler. Örneğin, florür oksit O içinde2 F2- .

Oksijeni içeren çok sayıda bileşik vardır. Bunlar, aşağıdaki gibi maddelerin sınıflarıdır:
- oksitler;
- peroksitler;
- ozonitler;
- süperoksit;
- asit;
- zeminler;
- tuzu;
- organik moleküller.
Tüm elementlerle oksijen içeri girebilir.Asil koşullar altında, soy metaller, helyum, neon ve argon ve halojenler hariç reaksiyonlar. İnert gazlarla, hiçbir koşulda etkileşime girmez.
Endüstride bulunmak
Su ve hava oksijen içeriği çok büyük (21 ve% 88, sırasıyla), bunun sentezi, sıvı hava ve su elektroliz fraksiyonel damıtma ana endüstriyel bir yöntemdir.
İlk yöntem özellikle sıkça kullanılır. Sonuçta, bu gazın birçoğu havadan izole edilebilir. Ancak, tamamen temiz olmayacaktır. Daha yüksek kalitede bir ürün gerekirse, elektroliz işlemleri başlatılır. Bunun için hammadde ya su ya da alkalidir. Çözeltinin elektrik iletkenliğini arttırmak için sodyum veya potasyum hidroksit kullanılır. Genel olarak, işlemin özü suyun ayrışmasına indirgenir.

Laboratuarda Başlarken
Laboratuvar yöntemleri arasında ısıl işlem yöntemi yaygınlaşmıştır:
- peroksitler;
- oksijen içeren asitlerin tuzları.
Yüksek sıcaklıklarda ayrışırlar.gaz halindeki oksijenin serbest bırakılması. Süreç genellikle manganez (IV) oksit tarafından katalize edilir. Oksijen, suyun yer değiştirmesiyle toplanır ve bir yanıcı ışınla bulunur. Bildiğiniz gibi, bir oksijen atmosferinde, alev çok parlak bir şekilde parlar.
Üretmek için kullanılan başka bir maddeOkul kimya derslerinde oksijen, - Hidrojen peroksit. Katalizörün etkisi altında% 3'lük çözelti bile, saf gazın serbest kalması ile anında ayrışır. Sadece toplanması gerekiyor. Katalizör aynıdır - manganez oksit MnO2.
En sık kullanılan tuzlar şunlardır:
- bertholets tuzu veya potasyum klorat;
- potasyum permanganat veya manganez.
Süreci tanımlamak için denklemi verebiliriz. Laboratuvar ve araştırma ihtiyaçları için oksijen yeterlidir:
2KClO3 = 2KCl + 3O2↑.
Oksijenin allotropik modifikasyonları
Oksijenin sahip olduğu bir allotropik modifikasyon var. Bu bileşiğin formülü O3ozon denir. Ultraviyole ve yıldırım deşarjlarının etkisiyle hava şartlarında oksijenin etkisi altında doğal koşullarda oluşan bir gazdır. O'nun aksine2Ozon, yıldırım ve gök gürültüsü ile yağmurdan sonra havada hissedilen hoş bir tazelik havasına sahiptir.
Oksijen ve ozon arasındaki fark, moleküldeki sadece atom sayısı değil, aynı zamanda kristal kafes yapısında da bulunur. Kimyasal olarak, ozon daha güçlü bir oksitleyicidir.
Oksijen hava bileşenidir
Doğada oksijen dağılımı çok geniştir. Oksijen bulunur:
- kayalar ve mineraller;
- su tuzlu ve taze;
- toprak;
- bitki ve hayvan organizmaları;
- Üst atmosferi içeren hava.
Açıkçası, Dünya'nın tüm kabukları onun tarafından işgal edildi -litosfer, hidrosfer, atmosfer ve biyosfer. Özellikle önemli olan içeriğindeki içeriğidir. Sonuçta, insan da dahil olmak üzere yaşam formlarının gezegenimizde var olmasına izin veren bu faktördür.

Soluduğumuz havanın bileşimi son derece heterojendir. Hem sabit bileşenleri hem de değişkenleri içerir. Değişmeyen ve her zaman mevcut olan:
- Karbon dioksit;
- oksijen;
- azot;
- soy gazlar.
Değişkenler arasında su buharı, toz partikülleri, yabancı gazlar (egzos, yanma ürünleri, çürüme vb.), Bitki poleni, bakteri, mantar ve diğerleri bulunur.
Doğada oksijenin önemi
İçinde ne kadar oksijen bulunduğu çok önemlidir.doğası. Büyük gezegenlerin (Jüpiter, Satürn) bazı uydularında bu gazın eser miktarlarının keşfedildiği biliniyor, ancak orada belirgin bir yaşam yoktur. Dünyamızın suyla birlikte tüm canlı organizmaların var olmasını mümkün kılan yeterli bir sayısı vardır.
Buna ek olarak, o nefes aktif bir üyesi olan, oksijen natürmort için serbest enerji neden sayısız oksitlenme reaksiyonları geçirir.
Bu eşsiz gazın ana tedarikçileridoğa yeşil bitkiler ve bazı bakteri türleridir. Bu sayede sabit bir oksijen ve karbondioksit dengesi korunur. Buna ek olarak, ozon, tüm Dünya üzerinde, onu yok eden büyük miktarda ultraviyole radyasyonun girmesine izin vermeyen koruyucu bir ekran oluşturur.

Sadece bazı anaerobik organizmalar (bakteriler, mantarlar) oksijen atmosferinin dışında yaşayabilirler. Ancak, onlara çok ihtiyacı olanlardan çok daha azı var.
Endüstride oksijen ve ozon kullanımı
Endüstrideki allotropik oksijen modifikasyonlarının ana kullanım alanları aşağıdaki gibidir.
- Metalurji (metallerin kaynağı ve kesimi).
- İlaç.
- Tarım.
- Bir roket yakıtı olarak.
- Patlayıcılar dahil olmak üzere birçok kimyasal bileşiğin sentezi.
- Suyun saflaştırılması ve dezenfeksiyonu.
Bu büyük gazın, eşsiz bir maddenin - oksijenin katılmadığı bir süreci bile adlandırmak zordur.
</ p>