Elektrolitlerin özellikleri. Güçlü ve zayıf elektrolitler. Elektrolitler - nedir?
Elektrik akımının mükemmel iletkenleri - altın,bakır, demir, alüminyum, alaşımlar. Onlarla birlikte, metalik olmayan maddelerin büyük bir grubu vardır, eriyikler ve sulu solüsyonları da iletkenlik özelliğine sahiptir. Bunlar, güçlü bazlar, asitler, bazı tuzlar, topluca "elektrolitler" olarak adlandırılır. İyonik iletkenlik nedir? Elektrolitlerin bu yaygın fenomene ne kadar bağlı olduklarını öğrenelim.

Hangi parçacıklar yük taşır?
Etrafındaki dünya farklı iletkenlerle doludur ve ayrıcaizolatörleri. Vücut ve maddelerin bu özellikleri eski zamanlardan beri bilinmektedir. Yunan matematikçi Thales kehribar ile deneyim kazandı (Yunanca "elektron"). İpekle ovuşturduktan sonra, bilim adamı, saçların, yünlerin liflerinin çekilmesi fenomenini gözlemledi. Daha sonra kehribarın yalıtkan olduğu biliniyor. Bu maddede elektrik yükü taşıyabilen herhangi bir partikül yoktur. İyi iletkenler metallerdir. Bileşiminde atomlar, pozitif iyonlar ve serbest, sonsuz küçük negatif parçacıklar - elektronlar vardır. Akım geçtiğinde şarj transferini sağlarlar. Kuru formdaki kuvvetli elektrolitlerde serbest partiküller bulunmaz. Fakat çözülme ve eritme sırasında, kristal kafes kopabilir ve kovalent bağın polarizasyonu da bozulur.
Su, elektrolit olmayan elektrotlar ve elektrolitler. Dağılma nedir?
Elektronları vererek veya iliştirerek, atomlarmetal ve metal olmayan elementler iyonlara dönüştürülür. Kristal kafes içinde aralarında oldukça kuvvetli bir bağlantı var. İyonik bileşiklerin eritilmesi veya eritilmesi, örneğin sodyum klorür, yıkımına neden olur. Kutup moleküllerinde ne bağlı ne de serbest iyon vardır, su ile etkileşimde bulunurlar. XIX yüzyılın 30'lu yıllarında M. Faraday, bazı maddelerin çözümlerinin akım yürüttüğünü keşfetti. Bilim insanı bu önemli kavramları bilimsel olarak ortaya koydu:
- iyonlar (yüklü parçacıklar);
- elektrolitler (ikinci tür iletkenler);
- katot;
- anot.
Bileşikler var - güçlü elektrolitler, bunların kristal kafesleri iyonların salınmasıyla tamamen parçalanıyor.

Çözünmeyen maddeler var ve bunlarörneğin şeker, formaldehit gibi moleküler bir formda korunurlar. Bu tür bileşiklere elektrolitsiz denir. Onlar için yüklü parçacıkların oluşumu karakteristik değildir. Zayıf elektrolitler (kömür ve asetik asit, amonyum hidroksit ve bir dizi diğer madde) az miktarda iyon içerir.
Elektrolitik dissosiyasyon teorisi
Çalışmalarında İsveçli bilim adamı S. Arrhenius (1859-1927) Faraday'ın sonuçlarına dayanıyordu. Daha sonra, teorisinin hükümleri Rus araştırmacılar I. Kablukov ve V. Kistyakovsky tarafından netleştirildi. Çözündükleri ve erittiklerinde, tüm maddeleri değil yalnızca elektrolitleri oluşturduğunu öğrendiler. S. Arrhenius ayrışması nedir? Bu, çözeltilerde yüklü parçacıkların ortaya çıkmasına ve eriyen moleküllerin yokedilmesidir. S. Arrhenius'un temel teorik hükümleri:
- Çözeltilerdeki bazlar, asitler ve tuzlar ayrışmış haldedir.
- Reversibly iyonlara güçlü elektrolitler ayrılırlar.
- Zayıf iyonlar az sayıda iyon oluştururlar.

Bir maddenin ayrışma derecesinin göstergesi (onunçoğunlukla yüzde olarak ifade edilir), bozunmuş molekül sayısının iyonlara oranı ve çözeltideki toplam parçacık sayısıdır. Elektrolitler, bu göstergenin değeri% 30'dan fazla, zayıf olanlarda -% 3'ten az ise güçlüdür.
Elektrolitlerin özellikleri
S.'nin teorik sonuçları. Arrhenius, daha sonraki Rus bilim adamları tarafından yürütülen çözeltiler ve eriyiklerdeki fizikokimyasal işlemler ile desteklendi. Bazların ve asitlerin özellikleri açıklanmıştır. Birincisi katyonlardan çözeltilerinde sadece metal iyonlarının saptanabildiği bileşikler, anyonlar OH parçacıklarıdır-. Asit molekülleri asit tortusunun negatif iyonlarına ayrılır ve hidrojen protonları (H+). Çözeltideki ve eriyikteki iyonların hareketi kaotiktir. Bir zinciri bir araya getirmeniz, karbon elektrotları ve sıradan bir akkor ampulü içeren deney sonuçlarını göz önünde bulundurun. Farklı maddelerin solüsyonlarının iletkenliğini kontrol edelim: ortak tuz, asetik asit ve şeker (ilk iki elektrolit). Elektrik devresi nedir? Bu, birbirine bağlı bir akım kaynağı ve iletken kaynağıdır. Devre kapatıldığında ampul tuz çözeltisinde daha parlak yanacaktır. İyonların hareketi düzeni kazanır. Anyonlar pozitif elektroda, katyonlar ise negatif elektroda yönlendirilir.

Bu işlemde asetik asit katılıraz miktarda yüklü parçacıklar. Şeker bir elektrolit değil, akımı yönetmez. Bu çözümde elektrotlar arasında izolasyon tabakası olacak, ampul yanmayacak.
Elektrolitler arasındaki kimyasal etkileşimler
Çözümler boşaldığında, nasıl liderlik edeceğini gözlemleyebilirKendinize elektrolitler. Benzer reaksiyonların iyonik denklemleri nedir? Örneğin baryum klorür ve sodyum nitrat arasındaki kimyasal etkileşimi göz önünde bulundurun:
2NaNO3 + BaCl2 + = 2NaCl + Ba (NO3)2.
Elektrolitlerin formülleri iyonik formda yazılabilir:
2Na+ + 2NO3 + Ba2+ + 2C1- = 2Na+ + 2C1- + Ba2+ + 2NO3.
Reaksiyon için alınan maddeler kuvvetli elektrolitlerdir. Bu durumda, iyonların bileşimi değişmez. Elektrolit çözeltileri arasındaki kimyasal etkileşim üç durumda mümkündür:
1. Ürünlerden biri çözülmeyen bir maddedir.
Moleküler denklem: Na2SO4 + BaCl2 = BaS024 + 2NaCl.
Elektrolitlerin kompozisyonunu iyon formunda yazalım:
2Na+ + Öyleyse42- + Ba2+ + 2C1- = BaS024 (beyaz çökelti) + 2Na+ 2Cl-.
2. Oluşturulan maddelerden biri de gazdır.
3. Tepkime ürünleri arasında zayıf bir elektrolit vardır.
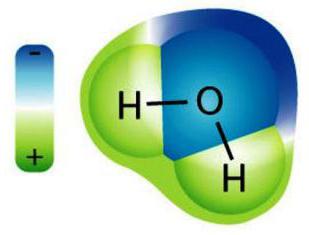
Su en zayıf elektrolitlerden biridir
Kimyasal olarak saf su (damıtılmış) elektrik akımı yürütmez. Ancak kompozisyonunda az miktarda yüklü parçacıklar vardır. Bunlar H protonlarıdır.+ ve anyonlar OH-. Göz ardı edilebilir sayıda su molekülü ayrışmaya uğrar. 25 ° C sıcaklıkta sabit olan suyun iyon ürünü olan bir değer vardır H'nin konsantrasyonlarını bilir+ ve OH-. Hidrojen iyonları asit çözeltilerinde ağırlıklı olup, hidroksit anyonları alkalilerde daha büyüktür. Nötr durumda - sayı H+ ve OH-. Çözelti ortamı ayrıca hidrojen indeksini (pH) karakterize eder. Yüksek olanı, daha fazla hidroksit iyonu bulunur. Ortam, 6-7'ye yakın bir pH aralığında nötrdür. H iyonlarının mevcudiyetinde+ ve OH- renk göstergesi maddelerini değiştirin: litus, fenolftalein, metilorange ve diğerleri.
Elektrolitlerin eriyiklerinin ve eriyiklerinin özelliklerisanayi, mühendislik, tarım ve tıpta yaygın olarak kullanılmaktadır. Bilimsel gerekçe, tuzların, asitlerin ve bazların oluşturduğu parçacıkların davranışını açıklayan çok sayıda seçkin bilim adamının eserlerinde ortaya konmuştur. Çözümlerinde, çeşitli iyon değişim reaksiyonları oluşur. Elektrokimya, elektroliz tesislerinde birçok endüstriyel proseslerde kullanılırlar. Canlılardaki işlemler, çözeltilerdeki iyonlar arasında da meydana gelir. Yüklü parçacıklar (sodyum, potasyum, magnezyum, klor, fosfor ve diğerleri) formunda atom ve moleküller şeklinde zehirli birçok metal olmayan metaller vazgeçilmezdir.
</ p>


