Elektrolitler: örnekler. Elektrolitlerin bileşimi ve özellikleri. Güçlü ve zayıf elektrolitler
Kimyasal olarak elektrolitler bilinenantik zamanlar. Bununla birlikte, uygulamanın büyük bölümünde nispeten yeni bir kazanç elde edilmiştir. Bu maddelerin endüstride kullanımı için en öncelikli alanları tartışacağız ve bu maddelerin neyi temsil ettiğini ve birbirlerinden nasıl farklı olduklarını anacağız. Ama tarih turuyla başlayalım.

öykü
Bilinen en eski elektrolitler tuzlardır veAsitler, Antik Dünya'da keşfedildi. Bununla birlikte, elektrolitlerin yapısı ve özellikleri ile ilgili fikirler zamanla gelişmiştir. Bu işlemlerin teorileri, elektrolit özellikleri teorileri ile ilgili olarak birkaç keşif yapıldığında 1880'li yıllardan başlayarak gelişti. Elektrolitlerin su ile etkileşim mekanizmalarını açıklayan teorilerde (aslında, yalnızca sanayide kullandıkları özellikleri edinen çözüm) niteliksel sıçramalar gözlemlenmiştir.
Şimdi çeşitli teorileri ayrıntılı olarak tartışacağız,elektrolitler ve özellikleriyle ilgili fikirlerin gelişiminde en büyük etkiye sahip olan Ve her birimizin okulda geçirdiği en yaygın ve basit teori ile başlayın.
Elektrolitik dissosiyasyon teorisi Arrhenius
1887'de İsveçli kimyager Svante Arrhenius veRus-Alman kimyager Wilhelm Ostwald, elektrolitik ayrışma teorisini yarattı. Ancak, burada da, o kadar basit değil. Arrhenius, kurucu maddenin su ile olan etkileşimini hesaba katmayan ve çözeltide serbest yüklü parçacıkların (iyonlar) olduğunu iddia eden sözde fiziksel çözüm teorisinin bir destekçisiydi. Bu arada, günümüzde okuldaki elektrolitik ayrışmanın göz önüne alınması böyle bir konumdadır.
Hala bu teori ne verdiği ve maddelerin su ile etkileşim mekanizmasını nasıl açıkladığı hakkında konuşalım. Diğerleri gibi o da kullandığı birkaç önermeye sahiptir:
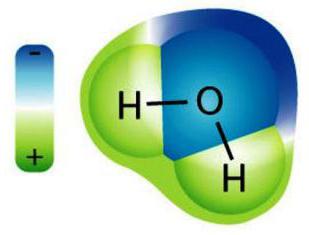
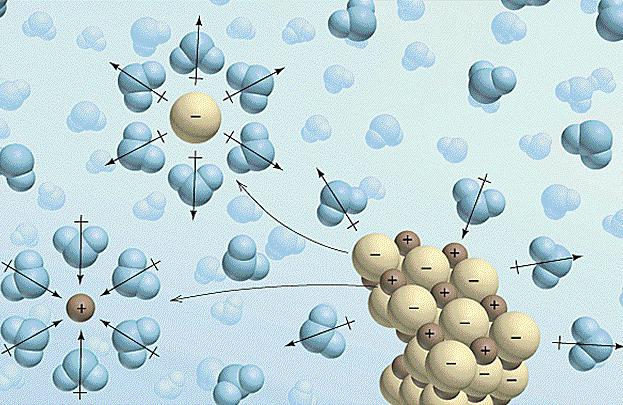
1. (- negatif katyon - anyon pozitif) su malzeme ile temas halinde iyon dağılır. su kompleksleri (solvatlar) içinde oluşturulması için negatif (oluşturulan dipol) - Bu parçacıklar, bu arada, kesin ve diğer bir taraftan şarj su molekülleri çekecek hidrasyona tabi tutulur.
2. Ayrışma işlemi tersine çevrilebilirdir - yani, madde iyonlara ayrılmışsa, o zaman bazı faktörlerin etkisi altında tekrar başlangıçtaki haline dönüşebilir.
3. Elektrotları çözeltiye bağlar ve akımı başlatırsanız, katyonlar negatif elektroda (katot ve anyonlar pozitif yüklü anotlara) hareket etmeye başlayacaktır. Bu nedenle suda çok çözünen maddeler sudan daha iyi bir elektrik akımı uygularlar. Aynı nedenle elektrolitler deniyordu.
4. Elektrolitin ayrışma derecesi, çözünme geçiren maddenin yüzdesini karakterize eder. Bu gösterge, çözücünün ve en çok çözünen maddenin, ikincinin konsantrasyonu ve dış sıcaklık üzerindeki özelliklerine bağlıdır.
İşte, aslında, ve tüm bu temel postularbasit bir teori. Elektrolit çözeltisinde neler olduğunu tanımlamak için bu makalede kullanılacaktır. Bu bileşiklerin örnekleri daha sonra tartışılacak, ancak şimdi başka bir teori ele alacağız.

Lewis teorisi ve asit teorisi
Elektrolitik ayrışma teorisine göre, asitbir hidrojen katyonu bulunan çözeltideki bir maddedir ve baz çözeltide bir hidroksit anyonuna ayrışan bir bileşiktir. Ünlü kimyager Gilbert Lewis'in adını taşıyan başka bir teori var. Asit ve baz kavramını biraz genişletmemizi sağlar. Lewis teorisine göre, asitler, serbest elektron orbitallerine sahip olan ve başka bir molekülden bir elektronu alabilen madde veya iyon molekülleridir. Bazların, elektronlarından bir veya daha fazlasını asidin "kullanımı" na verebilen parçacıklar olacağını tahmin etmek kolaydır. Burada asit veya bazın sadece elektrolit değil, suda bile çözünmeyen herhangi bir madde olabileceği çok ilginç.

Brandsted-Lowry'nin prototip teorisi
1923 yılında, birbirinden bağımsız olarak, ikiBilim adamları - J. Brønsted ve T. Lowry - bilim adamları tarafından kimyasal süreçleri tanımlamak için aktif olarak kullanılan bir teori önermişlerdir. Bu teorinin özü, ayrışmanın anlamının, protonun asitten tabana aktarılmasına indirgenmesidir. Böylece, ikincisi burada bir proton alıcısı olarak anlaşılmaktadır. Sonra asit onların vericisidir. Teori aynı zamanda özellikleri ve asitleri ve bazları sergileyen maddelerin varlığını da açıklar. Bu gibi bileşikler amfoterik olarak adlandırılır. Bronsted-Lowry teorisinde, amfolitler terimi de onlar için kullanılırken, asit veya bazlar genellikle protolitler olarak adlandırılır.
Makalenin bir sonraki bölümüne geldik. İşte size neyi farklı güçlü ve zayıf elektrolitler göstermek ve onların özelliklerine dış faktörlerin etkisini ele alacağız. Ve sonra pratik uygulamanın açıklaması geçmek için.
Güçlü ve zayıf elektrolitler
Her madde su ile etkileşime girertek tek. Bazıları iyice çözülür (örneğin, sofra tuzu), ve bazıları hiç çözünmez (örneğin, tebeşir). Böylece tüm maddeler güçlü ve zayıf elektrolitlere ayrılır. İkincisi, su ile zayıf bir şekilde etkileşime giren ve çözeltinin dibine yerleşmiş maddelerdir. Bu, molekülün normal koşullar altında bileşen iyonlarına ayrılmasına izin vermeyen, çok düşük bir ayrışma derecesine ve yüksek bir bağlanma enerjisine sahip oldukları anlamına gelir. Zayıf elektrolitlerin ayrışması ya çok yavaş gerçekleşir ya da bu maddenin çözeltideki sıcaklığı ve konsantrasyonu artar.
Güçlü elektrolitler hakkında konuşalım. Bunlar, çözünebilir tuzların yanı sıra güçlü asitler ve alkalileri içerir. Kolayca iyonlara dönüşürler ve bunları çökelti içinde toplamak çok zordur. Bu arada, elektrolitlerdeki akım, tam olarak çözeltide bulunan iyonlar tarafından gerçekleştirilir. Bu nedenle, en iyi elektrolit akımı iletir. Sonuncusu örnekleri: güçlü asitler, alkaliler, çözünür tuzlar.
Elektrolitlerin davranışını etkileyen faktörler
Şimdi dışarıdaki değişimin nasıl olduğunu görelimMaddelerin özellikleri ile ilgili durum. Konsantrasyon, doğrudan elektrolitin ayrışma derecesini etkiler. Dahası, bu ilişki matematiksel olarak ifade edilebilir. Bu bağlantıyı anlatan yasaya Ostwald'ın dilüsyon yasası denir ve aşağıdaki gibi yazılır: a = (K / c)1/2. Burada, bir ayrışma derecesidir (fraksiyonlar, K, ayrışma sabiti, her madde için farklıdır ve c, solüsyondaki elektrolit konsantrasyonudur. Bu formüle göre, madde ve çözümdeki davranışları hakkında çok şey öğrenebilir.
Ama biz konudan saptık. Konsantrasyona ek olarak, ayrışma derecesi de elektrolitin sıcaklığından etkilenir. Çoğu madde için, bu artış çözünürlüğü ve kimyasal aktiviteyi arttırır. Belirli reaksiyonların seyrini sadece yüksek sıcaklıkta açıklayabilen budur. Normal koşullar altında, ya çok yavaş ya da her iki yönde giderler (bu süreç geri dönüşümlü olarak adlandırılır).
Elektrolit çözeltisi olarak böyle bir sistemin davranışını belirleyen faktörleri analiz ettik. Şimdi bunların pratik uygulamalarına, şüphesiz çok önemli kimyasallara dönüyoruz.

Endüstriyel kullanım
Tabii ki herkes "elektrolit" kelimesini duydupillere uygulanır. Araba kurşun asitli piller, yüzde 40 sülfürik asit gerçekleştiren elektrolit rolünü kullanıyor. Bu maddeye neden ihtiyaç duyulduğunu anlamak için, pilin özelliklerini anlamak gerekir.
Peki herhangi bir pilin prensibi nedir? İçlerinde bir maddenin bir diğerine dönüşümünün tersine çevrilebilir bir reaksiyonu gerçekleşir, bunun sonucu olarak elektronlar serbest bırakılır. Pil şarj edildiğinde, normal koşullar altında elde edilmeyen maddelerin etkileşimi vardır. Bu, kimyasal bir reaksiyon sonucunda bir maddede elektrik birikmesi olarak temsil edilebilir. Deşarj başladığında, ters dönüşüm başlar ve sistemi başlangıç durumuna getirir. Bu iki süreç birlikte bir şarj boşaltma çevrimini oluşturur.
Belirli bir süreçte yukarıdaki süreci düşününörnek - bir kurşun asit batarya. Tahmin edebileceğiniz gibi, bu akım kaynağı kurşun içeren bir elementten (ayrıca kurşun dioksit PbO'dan oluşur)2) ve asitler. Herhangi bir batarya elektrotlardan ve sadece elektrolit ile doldurulmuş aralarındaki boşluktan oluşur. Son olarak, daha önce de açıkladığımız gibi, bizim örneğimizde sülfürik asit yüzde 40'lık bir konsantrasyonla kullanılır. Böyle bir pilin katodu kurşun dioksitten yapılır ve anot saf kurşundan oluşur. Tüm bunlar, bu iki elektrotta, asitin ayrıştığı iyonları içeren farklı tersine çevrilebilir reaksiyonlar olduğudur.
- PbO2 + Öyleyse42-+ 4H+ + 2e- = PbSO4 + 2H2O (negatif elektrot-katotta meydana gelen reaksiyon).
- Pb + SO42- - 2e- = PbSO4 (Pozitif elektrot anotta akan reaksiyon).
Eğer tepkileri soldan sağa okursak,meydana gelen süreçler pil deşarj sırasında ve sağ eğer - bir ücret ödemeden. Bu reaksiyonların her biri kimyasal akım kaynağı farklı olan, ama genel olarak oluşma mekanizması aynı açıklanmaktadır: elektronlar "emilen" vardır ve bunlardan biri iki işlem vardır ve diğer, tersine, "git". En önemli şey absorbe elektron sayısı yayınlanan sayıya eşit olmasıdır.
Aslında, piller yanında, bir kitle varbu maddelerin uygulamaları. Genel olarak, örnek verdiğimiz elektrolitler, bu terim altında birleştirilen maddelerin çeşitliliğinin sadece bir tanesidir. Heryerde bizi çevreliyorlar. Burada örneğin insan vücudu var. Bu maddelerin orada olmadığını düşünüyor musunuz? Çok yanlış. İçimizdeki her yerdeler ve en büyük sayı, kandaki elektrolitlerden oluşur. Bunlar arasında, örneğin, hemoglobinin bir parçası olan ve vücudumuzun dokularına oksijen taşınmasına yardımcı olan demir iyonları bulunur. Kanın elektrolitleri de su-tuz dengesini ve kalbin çalışmasını düzenlemede önemli bir rol oynar. Bu işlev potasyum ve sodyum iyonları ile gerçekleştirilir (potasyum-sodyum pompası olarak adlandırılan hücrelerde bile gerçekleşen bir işlem bile vardır).
Çözebileceğiniz maddeleren azından biraz elektrolitler. Ve uygulandıkları her yerde böyle bir sanayi dalı ve yaşamımız yok. Sadece arabalar ve pillerdeki piller değil. Bu herhangi bir kimyasal ve gıda üretimi, askeri fabrikalar, konfeksiyon fabrikaları vb.
Bu arada, elektrolit bileşimi farklıdır. Böylece, asit ve alkali elektroliti izole etmek mümkündür. Temel olarak özellikleri bakımından farklılık gösterirler: daha önce söylediğimiz gibi, asitler protonların ve alkali alıcıların donörleridir. Ancak, elektrolit bileşimi, maddenin bir kısmının kaybına bağlı olarak değiştiği zaman, konsantrasyon ya azalır ya da artar (her şey kaybolan, suya ya da elektrolitlere bağlıdır).
Onlarla her gün karşı karşıyayız, ama çok az insan tam olarak elektrolit gibi bir terimin tanımını biliyor. Belirli maddelerin örnekleri, biz söküldü, bu yüzden biraz daha karmaşık kavramlara geçelim.

Elektrolitlerin fiziksel özellikleri
Şimdi fizik hakkında. Bu konu üzerinde çalışırken anlamanız gereken en önemli şey, akımın elektrolitlere nasıl aktarıldığıdır. Buradaki belirleyici rol iyonlar tarafından oynanır. Bu yüklü parçacıklar, çözeltinin bir kısmından diğerine yük taşıyabilir. Böylece, anyonlar her zaman pozitif elektrota ve negatif elektroda katyonlara yönelirler. Böylece, bir elektrik akımı ile çözüm üzerinde hareket ederek, ücretleri sistemin farklı taraflarına bölüyoruz.
Çok ilginç bir fiziksel özellik,yoğunluğu olarak. Tartıştığımız bileşiklerin birçok özelliği buna bağlı. Ve genellikle bir soru ortaya çıkıyor: "Elektrolit yoğunluğu nasıl yükseltilir?" Aslında, cevap basit: Çözeltinin su içeriğini azaltmanız gerekiyor. Elektrolitin yoğunluğu esas olarak sülfürik asit yoğunluğu tarafından belirlendiğinden, esas olarak ikincinin yoğunluğuna bağlıdır. Bunu başarmanın iki yolu vardır. Birincisi oldukça basit: bataryada bulunan elektrolit kaynatın. Bunu yapmak için, içindeki sıcaklığın yüz santigrat derecenin biraz üzerine çıkması için şarj etmeniz gerekir. Bu yöntem yardımcı olmazsa, endişelenmeyin, bir tane daha var: eski elektroliti yenisiyle değiştirin. Bunu yapmak için eski çözeltiyi boşaltın, sülfürik asit kalıntılarını damıtılmış suyla temizleyin ve yeni bir parça dökün. Kural olarak, elektrolitin kalitatif çözümleri hemen gerekli konsantrasyon değerine sahiptir. Değişimden sonra, uzun süre elektrolit yoğunluğunu nasıl artıracağınızı unutabilirsiniz.
Elektrolit bileşimi büyük ölçüde onunözellikleri. Örneğin, elektriksel iletkenlik ve yoğunluk gibi özellikler, çözünmüş maddenin yapısına ve konsantrasyonuna kuvvetle bağlıdır. Bataryada ne kadar elektrolit olduğu konusunda ayrı bir soru var. Aslında, hacmi doğrudan ürünün beyan edilen kapasitesi ile ilgilidir. Akü içinde daha fazla sülfürik asit, ne kadar güçlü olursa, voltaj artar.

Nerede yararlı?
Bir araba tutkunu iseniz ya da sadece keskinarabalar, sonra her şeyi kendiniz anlıyorsunuz. Şüphesiz, aküdeki elektrolitin ne kadar olduğunu nasıl belirleyeceğinizi bile biliyorsunuzdur. Ve eğer arabalardan uzaksanız, bu maddelerin özelliklerine, uygulamalarına ve birbirleriyle nasıl etkileşime girdiklerine dair bilgi gereksiz olmayacaktır. Bunu bildiğinizde, hangi elektrolitin pilde olduğunu söylemeniz istenirse bir kayıp olmayacaksınız. Her ne kadar bir araba tutkunu olmasanız da, bir arabanız olsa da, pil cihazının bilgisi gereksiz olmayacaktır ve onarımda size yardımcı olacaktır. Araba merkezine gitmek yerine, her şeyi kendiniz yapmak çok daha kolay ve daha ucuz olacak.
Ve bu konuyu daha iyi araştırmak içinokullar ve üniversiteler için kimya ders kitabını oku. Bu bilimi iyi biliyor ve yeterince ders kitabı okursanız, en iyi seçenek "Kimyasal akım kaynakları" Varypaev olacaktır. Akümülatörlerin, çeşitli akülerin ve hidrojen elemanlarının çalışmasının bütün teorisi burada ayrıntılı olarak ortaya konmuştur.
Sonuç
Sonundayız. Özetleyelim. Yukarıda, elektrolitler gibi bir kavramla ilgili her şeyi parçalara ayırdık: örnekler, yapı ve özellikler teorisi, işlevler ve uygulamalar. Bir kez daha, bu bileşiklerin yaşamımızın bir parçası olduğunu söylememize gerek yok, bedenlerimiz ve tüm endüstrilerimiz var olamazdı. Kan elektrolitlerini hatırlıyor musun? Onların sayesinde yaşadık. Makinelerimiz ne olacak? Bu bilginin yardımıyla, pil ile ilgili herhangi bir sorunu giderebiliriz, çünkü şimdi elektrolit yoğunluğunu nasıl arttıracağımızı anlıyoruz.
Her şey söylenemez ve böyle bir hedef koymadık. Sonuçta, bu şaşırtıcı maddeler hakkında söylenebilecek her şey bu değil.
</ p>